Одной из важных экологических проблем нефтегазовой промышленности при освоении шельфовых месторождений Арктики являются выбросы диоксида углерода в окружающую природную среду. Сжигание углеводородных топлив органического происхождения приводит к образованию диоксида углерода - СО2, который является парниковым газом, по одной из гипотез приводящим к глобальному антропогенному потеплению.
В начале 2000-х годов ученые полагали, что они нашли способ уберечь человечество от основных угроз, связанных с глобальным потеплением. Предполагалось, что если удержать его на уровне менее 2° С, это позволит избежать таких катаклизмов, как катастрофическое повышение уровня океана и жестокие засухи. Для этого требовалось ограничить содержание парникового газа CO2 в атмосфере в пределах в 450 миллионных долей. Однако сегодня стало ясно, что эти оценки были слишком оптимистичными. Данные, поступающие со всего света, показывают, что планета меняется быстрее, чем многие думали. В Северном Ледовитом океане исчезло больше льда, чем ожидалось. Выделение метана, тоже действенного парникового газа, в зонах вечной мерзлоты на Аляске и в Сибири, оказалось масштабнее, чем прогнозировала модель. Шельфовые ледники на западе Антарктиды разрушаются быстрее, чем считалось возможным, а подпираемые ими ледники на суше сползают в море с более высокой скоростью, чем предполагалось [1].
Для очистки газовых выбросов от диоксида углерода в настоящее время существует большое количество технологий, основанных на различных химических и физических принципах [2-7]. Недостатками применяемых реагентных методов являются образование шламов, сложность технологических схем и значительный расход дорогостоящих реагентов, а каталитические связаны с большими капитальными и эксплуатационными расходами.
На сегодняшний день для очистки отходящих газов промышленных предприятий в мире все большее место занимают каталитические технологии. Наибольший интерес представляют способы окисления, основанные на использовании экологически чистого окислителя — молекулярного кислорода. Основная сложность сводится к его активации, так как O2 в стандартных условиях мало реакционноспособен. Химическое взаимодействие обычного кислорода, электронное состояние которого является триплетным, с большинством соединений в основном синглетном состоянии протекает крайне медленно. Поэтому окислительные каталитические реакции с кислородом протекают в многофазных системах при довольно жестких условиях по температуре с образованием катион-радикалов (О∙, HO∙) [8].
Трифторуксусная кислота (ТФК) широко используется в органическом синтезе как растворитель при осуществлении окислительных реакций [9–21], что связано с ее способностью растворять молекулярный кислород. В работе [22] показано, что фторсодержащие (ФС) соединения образуют весьма прочные комплексы с молекулярным кислородом.
В данной работе предлагается каталитический способ очистки отходящих дымовых газов от парникового газа – СО2 с применением растворов ТФК. Преимуществом предлагаемого подхода является проведение процесса при стандартных давлении и температуре, а также использование достаточно неагрессивной среды растворов ТФК, не требующее больших эксплуатационных расходов
Экспериментальные исследования
Очистку отходящих газов от диоксида углерода исследовали при стандартных параметрах температуры и давления (200С, 101,3 кПа) (Рис.1). Исследуемый газ с постоянной скоростью пропускали через емкость с раствором ТФК. Количество не вступившего в реакцию диоксида углерода определяли путем потенциометрического титрования раствора щелочи, в котором он улавливался. При этом показатель кислотности приемника газа постоянно контролировался. Титрование ловушки проскочившего газа проводили 1 М раствором соляной кислоты. При этом количество абсорбированного улавливаемого газа определяли по разнице между пропущенным количеством и результатом потенциометрического титрования.
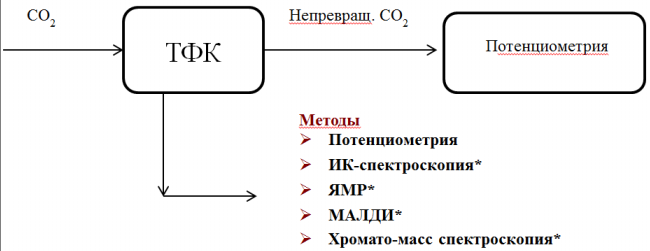
Рис. 1. Схема экспериментальной установки
Обсуждение результатов
Роль трифторуксусной кислоты заключается в образовании промежуточного карбоксильного радикала, продукт преобразования последнего представляет собой щавелевую кислоту [10].
ТФК в данных реакциях может рассматриваться как катализатор в присутствии растворенного O2, расход которого можно компенсировать путем насыщения реакционной среды кислородом воздуха. Таким образом, трифторуксусная кислота не только растворяет кислород, но и переводит его в активное состояние. В данной работе было определено влияние на абсорбцию СО2 концентрации трифторуксусной кислоты и рН среды.
При увеличении концентрации кислоты от 0,1 до 10,5 М количество поглотившегося диоксида углерода меняется незначительно (рис.2.). Заметное изменение абсорбировавшегося диоксида углерода наблюдается при переходе к безводной кислоте.
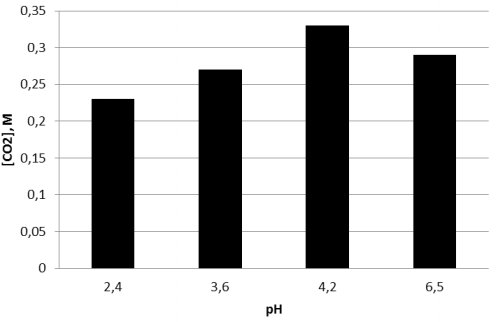
Рис. 2. Зависимость количества абсорбированного СО2 от концентрации раствора трифторуксусной кислоты
Влияние кислотности среды на абсорбцию парникового газа представлено на рис.3. Как видно из представленных данных наибольшая абсорбция наблюдается при значении кислотности равной 4,2. При уменьшении значения рН количество поглотившегося газа уменьшается, что наблюдается и при увеличении значения кислотности среды.
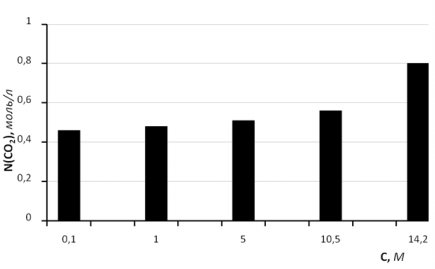
Рис.3. Абсорбция диоксида углерода в зависмости от кислотности среды
Этот способ включает прокачивание потока очищаемых газов через коллектор, заполненный 5,0-10,0 М водным раствором трифторуксусной кислоты. После насыщения в отработанный раствор подается воздух для регенерации каталитических свойств и отделяются образовавшиеся побочные продукты путем отстаивания, затем производится утилизация последних, В момент регенерации одного коллектора поток газа направляется на второй коллектор (Рис.4).
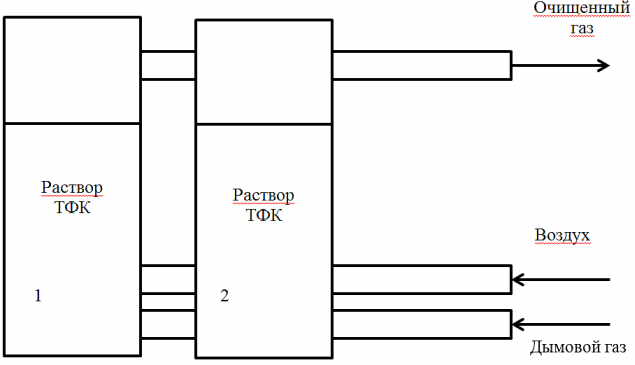
Рис. 4. Схема процесса снижения выбросов CO2 применительно к открытым, подземным и скважинным методам добычи полезных ископаемых
В результате проведенных исследований была выявлена способность трифторуксусной кислоты проводить превращение СО2 с образованием щавелевой кислоты, что позволит использовать подобные системы для очистки газовых выбросов даже при комнатной температуре и атмосферном давлении и определены оптимальные параметры кислотности среды и концентрации раствора кислоты.
Таким образом, на основании полученных данных предлагается использование растворов ТФК для очистки основного компонента парниковых газов, получаемых в результате сжигания топлив в промышленных предприятиях. Представленный способ позволяет проводить очистку газов диоксида углерода при стандартных условиях. При этом предложенный способ отличается простотой регенерации, нетоксичностью используемого катализатора. Диоксид углерода при данном способе утилизации представляет собой С1-синтон.
Заключение
Проведены экспериментальные исследования по утилизации диоксида углерода – продукта сгорания углеводородных топлив в нефтегазовой промышленности, приводящего к существенному изменению климата Арктических регионов.
Результаты исследований показали, что очистка от диоксида углерода может проводиться без больших затрат энергии при стандартны условиях, при этом процесс может быть реализован вне зависимости от концентрации диоксида углерода в выбросах. Подобная очистка дымовых выбросов отличается простотой регенерации катализатора (насыщение системы кислородом воздуха) и получением ценных продуктов (щавелевой кислоты) и возможных присадок к моторному топливу.
Как показали результаты проведенных исследований, оптимальным значением рН среды для абсорбции диоксида углерода является 4,2, а концентрация раствора кислоты влияет незначительно.
Литература
-
Джон К. Глобальное потепление: быстрее, чем ожидалось? – М.: Международное партнерство распространения научных знаний, 2013. - №1. – С. 40-47.
-
Абросимов А.А. Экология переработки углеводородных систем. – М.:Химия, 2002.- 608 с.
-
Лаптев А.Г., Фарахов М.И. Гидромеханические процессы в нефтехимии и энергетике: Пособие к расчету аппаратов. Казань: Изд-во Казанск.гос.ун-та, 2008. – 729 с.
-
Якимова И.Ю., Савицкая Ю.В., Вишнецкая М.В. Каталитическая очистка газовых выбросов от SO2//Технологии нефти и газа . – 2008. - №2. – С.56-58.
-
Вишнецкая М.В., Иванова М.С., Солкан В.Н., Жидомиров Г.М., Мельников М.Я. Активация молекулярного кислорода в трифторуксусной кислоте // Журнал физической химии. – 2012. – Т.86. - №5. – С.889-891.
-
Clark F. R. S., Norman R. O. C., Thomas C. B., Wilson J. S. Reactions of Palladium (II) with organic compounds. Part II. Oxidation of some Benzenoid compounds in trifluoroacetic acid // J. Chem. Soc. Perkin Trans. I. — 1974. — Р. 1289–1294.
-
Luo C, Dong W, GuY. Theory-guided access to efficient photodegradation of the simplest perfluorocarboxylic acid: trifluoroacetic acid // Chemosphere. – 2017. – V.181. – P.26-36.
-
Вишнецкая М.В., Иванова М.С., Свичкарев О.М., Будынина Е.М., Мельников М.Я. Превращения CO2 в растворах трифторуксусной кислоты // Журнал физической химии. – 2013. – Т.87. - №5. – С.742-744.
-
Вишнецкая М.В., Мельников М.Я. Особенности превращения органических и неорганических веществ в трифторуксусной кислоте // Журнал физической химии. – 2016. – Т.90. - №9. – С.1434-1436.
-
Мацуо М., Отоси С. Соединения фтора. — М.: Мир, 1990.
-
Асланов Л. А., Захаров М. А., Абрамычева Н. Л. Ионные жидкости в ряду растворителей. — М.: МГУ, 2005. — 272 с.
-
Koshi J. K. Formation and oxidation of alkyl radicals by cobalt (III) complexes // J. Am. Chem. Soc. — 1968. — V. 90. — № 19. — P. 5196–5207.
-
Гехман А. Е., Столяров И. П., Ершова Н. В., Моисеева Н. И., Моисеев И. И. Гидропероксидное окисление трудноокисляемых субстратов: беспрецедентный разрыв связи С-С в алканах, окисление молекулярного азота // Кинетика и катализ. — 2004. — Т. 45. — № 1. — С. 45–66.
-
Гехман А. Е., Моисеева Н. И., Моисеев И. И. Разложение пероксида водорода, катализируемое соединениями ванадия (V): пути образования озона // Изв. Акад. наук. Серия химическая. — 1995. — № 4. — С. 605–618.
-
Гехман А. Е., Моисеева Н. И., Моисеев И. И. // Координац. химия. — 1992. — Т. 18. — С. 3. 12.
-
Гехман А. Е., Моисеева Н. И., Блюмберг Э. А., Моисеев И. И. Образование О3 при каталитическом разложении Н2 О2 // Изв. Акад. наук. Серия химическая. — 1985. — С. 2653.
-
Hart H., Buehler C. A. Peroxytrifluoroacetic acid-boron fluoride as a source of positive hydroxyl // J. Org. Chem. — 1964. — V. 29. — №8. — P. 2397–2400.
-
Моисеева Н. И., Гехман А. Е., Блюмберг Э. А., Моисеев И. И. Катализируемое ванадием (+5) окисление бензола и его производных гидропероксидами // Кинетика и катализ. — 1988. — Т. 29. — С. 970–974.
-
Бучаченко А. Л. Комплексы молекулярного кислорода с органическими молекулами // Успехи химии. — 1985. — Т. 54. — Вып. 2. — С. 195–212.
-
Сидоренкова И. А., Якимова И. Ю., Вишнецкая М. В., Пономарева О. А. Сверхкислоты как катализаторы окислительных процессов // Журнал физической химии. — 2005. — №8. — С. 1526–1527.
-
Вишнецкая М. В., Якимова И. Ю., Сидоренкова И. А. Сверхкислоты как катализаторы окисления неорганических субстратов // Журнал физической химии. — 2006. — № 2. — С. 236–238
-






