В работе представлены результаты исследований совместного превращения адсорбированного на поверхности алюмоплатинового катализатора форм метана с н-пентаном в неокислительных условиях. Изучена реакционная способность адсорбированных Н-дефицитных форм метана в образовании бензола при взаимодействии с н-пентаном в присутствии катализатора 0,5%Pt/γ-Al2O3.
Задачи совершенствования базовых процессов производства моторных топлив современной нефтеперерабатывающей промышленности (крекинг, риформинг) в последние десятилетия состояли в увеличении глубины превращения сырья, росте октановых чисел, увеличении длительности рабочих циклов катализаторов. Однако сейчас стало очевидным, что в условиях ограниченных нефтяных ресурсов и роста цен на нефть использование природного газа для получения компонентов моторных топлив и сырья для нефтехимии является актуальной задачей. Разведанные мировые ресурсы природного газа огромны. По данным статистического обзора мировой энергии компании «British Petroleum» за 2019 год эти запасы составляют 198,8 трил. м3. В настоящее время природный газ в основном используется в энергетических целях – для получения тепла и электрической энергии [2, 3]. Такое нерациональное использование природного газа наносит вред экологии (метан и продукт его полного окисления – углекислый газ, являются парниковыми газами) и экономике.
Разведанные мировые ресурсы природного газа огромны за 2019 год составляют
198,8 трлн. м3

Химическая переработка природного газа осложняется высокой термодинамической стабильностью его основного компонента – метана.
Известно несколько способов термокаталитической конверсии метана в окислительных и бескислородных условиях [5]. На сегодняшний день в промышленных масштабах реализована технология ступенчатой окислительной конверсии метана «газ – в жидкость» (ГВЖ) (английский эквивалент – «gas to liquid» (GTL)) [6]. Основой этой технологии является получение из метана синтез-газа (смесь СО и Н2) с последующей его переработкой в синтетическую нефть (синтез Фишера-Тропша) или кислородсодержащие соединения. Несмотря на значительные успехи (конверсия СО не менее 80 %, селективность по С5+ углеводородам не менее 50 %), на территории России не существует масштабного современного производства синтетических моторных топлив по технологии ГВЖ. В первую очередь это связано с тем, что стадия получения синтез-газа предполагает высокие капиталовложения и эксплуатационные затраты [6].
Привлекательным направлением неокислительной переработки природного газа является получение ароматических углеводородов из метана. Ароматические углеводороды являются высокооктановым компонентом автобензинов [7] и ценным сырьем для нефтехимии [8]. В 1993 году L. Wang c соавторами [9] предложили получать ароматические углеводороды путем прямой дегидроароматизации (ДГА) метана на цеолитных катализаторах при температурах ≥ 700 °С в неокислительных условиях. Существенными недостатками этого способа, которые останавливают его промышленное внедрение, являются низкие выходы целевого продукта и быстрая дезактивация цеолитсодержащей каталитической системы за счет образования отложений кокса при высоких температурах процесса [10].
С точки зрения термодинамики, превращение метана в присутствии других химических соединений является предпочтительным, поскольку оно может протекать при более низких температурах, чем прямая ДГА [11]. На сегодняшний день предприняты попытки повысить степень превращения метана и выход ароматических углеводородов путем совместной конверсии метана с алканами или алкенами [12-14]. Однако эти превращения также осуществлялись на цеолитных катализаторах, которые очень быстро теряют свою активность.
Коллективом авторов из Центра новых химических технологий ИК СО РАН, Института катализа СО РАН ведется разработка научных основ совместной переработки С1-С4 углеводородных газов и жидких нефтяных фракций для получения компонентов моторных топлив и сырья для нефтехимии.
Объемный состав природного газа в зависимости от месторождения изменяется следующим образом: метан – 55-99 %, этан – 1-10 %, пропан и бутаны – не более 10 %, углеводороды С5 и С5+ – 1-5 %, остальное – азот, углекислый газ, сернистые соединения, гелий.
Способ конверсии метана в неокислительных условиях
Разработанный способ переработки СН4 в ароматические углеводороды [15-16] в неокислительных условиях при умеренных температурах (475-550 °С) в присутствии алюмоплатинового катализатора (Pt/Al2O3) включает 2 этапа. На первом в установке автоклавного типа на нанесенной платине происходит хемосорбция метана с образованием адсорбированных поверхностных углеводородных фрагментов (СНх) и выделением в объем реактора водорода [17]: СН4→ CHх + H2. Второй этап – введение в реакционную среду (при температурах 475-550 °С) сореагентов, находящихся в жидком агрегатном состоянии при стандартных условиях. Выбор каталитической системы обусловлен тем, что катализатор Pt/Al2O3 является типичным катализатором процесса риформинга, который направлен на получение высокооктанового компонента автобензинов (риформата) и индивидуальных ароматических углеводородов [18].
В качестве модельного углеводорода был выбран н-пентан (С5Н12). Выбор обусловлен тем, что прямая ароматизация 1 моля н-пентана невозможна. Т.о., ароматические углеводороды в системе могут быть получены как результат взаимодействий адсорбированных на поверхности катализатора углеводородных фрагментов СНх с н-пентаном или за счет протекания вторичных реакций крекинга н-пентана.
Кроме того, н-пентан термодинамически более стабилен, чем его гомологи C5+. Следовательно, образование ароматических углеводородов при взаимодействии метана с С5+ алканами более благоприятно.
Термодинамический анализ [19] возможных направлений превращения метана с н-пентаном (V,T=const) показал, что образование бензола и толуола по реакциям между CH4 и C5H12 возможно при температурах выше ~420 и ~507 °С соответственно.
При этом образование толуола при взаимодействии метана с н-гексаном термодинамически вероятно при более низких температурах – выше ~427 °С.
При хемосорбции метана на поверхности катализатора (первая стадия) важной задачей является контроль степени дегидрирования СН4.
Это необходимо для того, чтобы образующиеся на поверхности каталитической системы углеводородные частицы проявляли высокую реакционную способность в момент подачи сореактантов в реактор (вторая стадия).
Решение этой задачи заключается в продуманном дизайне катализаторов и проведении превращений в оптимальных условиях.
Материалы и методы
Для исследования был синтезирован катализатор Pt/Al2O3. Платину наносили на γ-Al2O3 из водного раствора Н2PtCl6 из расчета 0,5% к массе носителя. Далее катализатор подвергали термической обработке по стандартной методике [20]. Содержание платины в приготовленном катализаторе контролировали методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (АЭС-ИСП). Размер частиц нанесенной платины оценивали методом просвечивающей электронной микроскопии высокого разрешения (ПЭМВР). Электронное состояние платины определяли методом инфракрасной спектроскопии диффузного отражения адсорбированного СО (ИКС ДО) на спектрометре «Shimadzu 8300» с приставкой DRS-8000 в соответствие с методикой, описанной в [20].
Хемосорбцию метана (>99.9 %об. Автогенный завод, Россия) изучали в диапазоне температур 25-550 °С. Образец катализатора загружали в обогреваемый автоклав, проводили предварительное восстановление в токе водорода (500 °С, 1 час), после чего для удаления с поверхности катализатора Н2 систему продували аргоном (2 часа при 500 °С и далее при плавном снижении температуры до 25 °С). При 25 °С в реактор подавали смесь метана и аргона (Ar – внутренний стандарт) при мольном соотношении СН4/Pt=10/1 [21]. При программируемом повышении температуры в реакторе производили периодический отбор газовых проб через каждые 25 °С. Разделение и анализ проб проводили на хроматографе «Кристалл Люкс-М» с двумя хроматографическими колонками и детекторами по теплопроводности. За температуру начала хемосорбции метана принимали температуру, при которой в реакторе было зафиксировано уменьшение количества метана относительно изначально поданного количества СН4 и обнаружен Н2 [17].
После изучения хемосорбции метана в реактор при температуре 550 °С подавали н-пентан (98.0 %мас., AppliChem, Германия) из расчета C5H12/Pt = 1/1 (мол.); время контакта (τ) – 60 с. Состав жидких и газообразных продуктов совместной конверсии метана (его адсорбированных форм) и н-пентана анализировали методом газовой хроматографии на хроматографах «Кристалл Люкс-М» и «Цвет-800». Также для сравнения в реактор с обработанным в аргоне катализатором (25-550 °С) подавали С5Н12 аналогично описанному выше способу и анализировали состав продуктов индивидуальной конверсии С5Н12. Выход продуктов рассчитывали на массу поданного С5Н12.
Содержание углеродных отложений на поверхности катализатора определяли методом кулонометрического титрования с использованием автоматического титратора «АН-7529».
Состав ароматических углеводородов, образующихся при совместном превращении меченого метана 13СН4 (99,5 %об., Aldrich Chemistry, США) и н-пентана в присутствии катализатора 0,5%Pt/Al2O3 (С5Н12/Pt=1/1, τ=60 с) в неокислительных условиях анализировали методом хромато-масс-спектрометрии изотопных отношений ХМС 13С/12С [22].
Обсуждение результатов

По данным АЭС-ИСП содержание платины в образце катализатора составило 0,50±0,02 % мас. На рис.1. представлен электронно-микроскопический снимок катализатора. По данным ПЭМВР платина в катализаторе находится в высокодисперсном состоянии, средний размер частиц равен ~1,1 нм (дисперсность ~100%).
Рис. 1. Электронно-микроскопический снимок катализатора 0,5%Pt/Al2O3
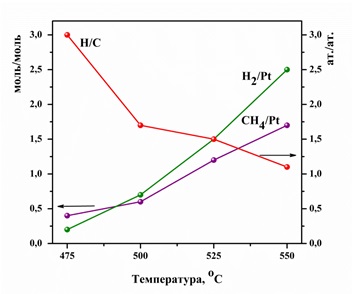
По данным ИКС ДО Pt в алюмоплатиновом катализаторе находится не только в металлическом состоянии (Pt0), но и в виде форм Ptδ+ и Pt2+. Эти формы имеют дефицит электронной плотности за счет сильного взаимодействия с носителем [23].
Установлено, что в присутствии катализатора Pt/Al2O3 с содержанием платины 0,5%мас. хемосорбция метана начинается при температуре 475 °С. Повышение температуры от 475 до 550 °С приводит к увеличению количества хемосорбированного СН4 (n, моль) и выделившегося Н2 (m, моль) (рис.2). Эти количества относили к содержанию платины в катализаторе: СН4/Pt и Н2/Pt (мол.). Так, при 550 °С количество хемосорбированного метана составляет 1,7 мольСН4/мольPt. Сверхстехиометрия адсорбции метана может быть обусловлена диффузией водорода с платины на носитель. Степень дегидрирования метана (атомное отношение Н/С) рассчитывали по формуле: Н/С(ат.)=(4n-2m)/n. Показано, что увеличение температуры в реакторе приводит к росту степени дегидрирования метана (рис.2).
После изучения хемосорбции метана на катализаторе 0,5%Pt/Al2O3 в реактор при температуре 550 °С подавали н-пентан. Обнаружено, что подача н-пентана к адсорбированному на катализаторе метану приводит к увеличению выхода ароматических углеводородов в 7,4 раза по сравнению с индивидуальным превращением н-пентана в присутствии катализатора, термообработанного в среде аргона (таблица 1). Кроме того, наблюдаются существенные количественные различия в выходах С1-С4 углеводородных газов (таблица 1).
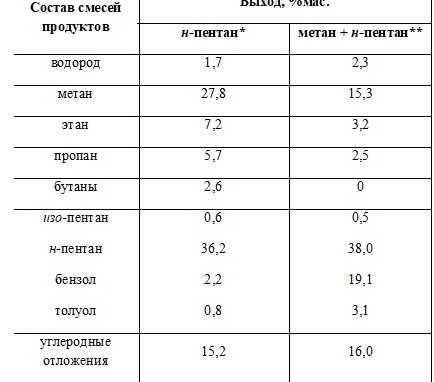
Таблица 1. Превращение н-пентана в присутствии катализатора 0,5%Pt/Al2O3 (550 °С)
Увеличение выхода ароматических углеводородов при совместном превращении адсорбированного метана и н-пентана по сравнению с индивидуальной конверсией н-пентана указывает на возможность образования новой связи C–C при взаимодействии адсорбированных на поверхности катализатора форм метана с С5-углеводородом. Для оценки реакционной способности адсорбированных на катализаторе 0,5%Pt/Al2O3 форм метана методом ХМС 13С/12С анализировали состав ароматических углеводородов, образующихся при совместном превращении меченого метана 13СН4 и н-пентана. Установлено, что при 550 °С 39,8 % полученного бензола содержат атом 13С, т.е. образуются с участием фрагментов 13СНх (рис.3). Остальные 60,2 % бензола, вероятно, образуются за счет протекания реакций крекинга н-пентана.
Ранее [20] с помощью метода ХМС 13С/12С с использованием 13СН4 нами была установлена прямая корреляция между степенью дегидрирования метана и реакционной способностью углеводородных фрагментов (13СНх) в образовании новых С–С связей при совместном превращении 13СНх с С5Н12 в неокислительных условиях. Показано, что уменьшение отношения Н/С адсорбированных на поверхности катализатора форм метана при увеличении температуры в реакторе приводит к потере их реакционной способности в реакциях образования ароматических углеводородов. В то же время участие СНх-частиц в образовании ароматических углеводородов при 550 °С позволяет заключить, что на поверхности катализатора 0,5%Pt/Al2O3 вместе с Н-дефицитными формами (расчетное среднее значение Н/С=1,1 при 550 °С, рис. 2) присутствуют и активные менее дегидрированные углеводородные частицы.
Мы полагаем, что при взаимодействии C5-углеводорода и CHx-частиц в неокислительных условиях в присутствии алюмоплатинового катализатора образование переходного комплекса с числом атомов углерода >5 является важной стадией образования ароматических углеводородов. Дальнейшие превращения протекают по бифункциональному механизму [18] с участием металлических и кислотных центров катализатора. При этом важную роль играют формы платины, имеющие дефицит электронов (Ptn+), которые ускоряют прямую C6-циклизацию. [23, 24].
По данным кулонометрического титрования содержание углеродных отложений на поверхности катализатора 0,5%Pt/Al2O3 после проведения адсорбционных и каталитических экспериментов составляет 0,1 %мас. Коксовые отложения на катализаторе Pt/Al2O3 после хемосорбции 13СН4 и совместного превращения адсорбированных на катализаторе углеводородных фрагментов 13СНх с н-пентаном анализировали методом ядерного магнитного резонанса на ядрах 13С [15, 22]. Установлено, что образующиеся коксовые отложения представляют собой наноразмерные кластеры графенов, которые содержат атомы 13С. Таким образом, эти структуры могли сформироваться как из адсорбированного метана, так и из предшественников ароматических углеводородов в результате их конденсации на поверхности катализатора.

Рис.3. Образование бензола в системе «13СН4 – н-пентан» в присутствии катализатора 0,5%Pt/Al2O3 при 550 °С
Адсорбированные на поверхности алюмоплатинового катализатора водорододефицитные формы метана проявляют реакционную способность в образовании ароматических углеводородов при превращении с н-пентаном в диапазоне температур 475-550 °С в неокислительных условиях. При этом, чем выше расчетное среднее отношение Н/С углеводородных фрагментов, тем большее количество адсорбированных форм метана участвует в реакциях образования бензола и толуола. Дезактивация активных центров алюмоплатинового катализатора вызвана образованием коксовых отложений (графеновых структур), однако она протекает медленнее, чем дезактивация цеолитных катализаторов. Полученные результаты послужат основой для создания технологии совместной переработки углеводородных газов и жидких нефтяных фракций в ценные продукты потребления.
Работа выполнена в рамках государственного задания Института катализа СО РАН (проект AAAA-A17-117021450095-1)

Литература:
1. Электронный ресурс. https://www.bp.com
2. B. Wang, S. Albarracín-Suazo, Y. Pagán-Torres, E. Nikolla // Catalysis Today. – 2017. – V.285. – P.147-158.
3. А.Г. Аншиц, Е.Н. Воскресенская // Соросовский образовательный журнал. – 1999. – №9. – С.38-43.
4. Черный И.Р. Производство сырья для нефтехимических синтезов., М.: Химия, 1983.
5. C. Karakaya, R.J. Kee //Progress in Energy and Combustion Science. – 2016. – V.55 – P.60-97.
6. В.З. Мордкович, Л.В. Синева, Е.В. Кульчаковская, Е.Ю. Асалиева // Катализ в промышленности. – 2015. – T.15. – C.23-45.
7. Маслянский Г.Н., Шапиро Р.Н. Каталитический риформинг бензинов, Л.: Химия, 1985.
8. Гайле А.А., Сомов В.Е. Варшавский О.М. Ароматические углеводороды. Выделение, применение, рынок, СПб.: Химиздат, 2000.
9. L.S. Wang et al. // Catalysis Letters. – 1993. – V.21. – P.35-41.
10. S. Ma et al. // Journal of Energy Chemistry. –2013. – V.22. – P.1-20.
11. J. Guo, H. Lou, X. Zheng // Journal of Natural Gas Chemistry. – 2009. –V.18. – P.260-272.
12. V. R. Choudhary, A.K. Kinage, T.V. Chourdhary // Science. – 1997. – V.275. – P.1286-1288.
13. J.F. Liu, Y. Liu, L.F. Peng // Journal of Molecular Catalysis A: Chemical. – 2008. – V.280. – P.7-15.
14. T. Baba, Y. Abe // Applied Catalysis A: General. – 2003. – V.250. – P.265-270.
15. Д.В. Голинский и др. // Российский химический журнал. – 2018. – Т. LXII. –№№ 1-2. –C.55-72.
16. Патент RU 2 655 927 C1.
17. M. Belgued et al. // Catalysis Today. – 1992. – V.13. – P.437-445.
18. Antos J., Aitani A.M., Parera J.M., Catalytic Naphtha Reforming: Science and Technology, Marcel Dekker inc, New York, 2004.
19. Жоров Ю.М. Термодинамика химических процессов, М.: Химия, 1985.
20. N.V. Vinichenko et al. // Kinetics and Catalysis. – 2018. – V.59. – P.378-385.
21. Н.В. Виниченко и др. // Химия в интересах устойчивого развития. – 2015. – T.23. – C.701-704.
22. D.V. Golinskii et al. // Kinetics and Catalysis. – 2016. – V.57. – P.504-510.
23. A.S. Belyi // Kinetics and Catalysis. – 2008. – V.49. – P.562-567.
Паал З., Чичери Ж. Каталитические реакции циклизации углеводородов. М.: Мир, 1988.






