Фенол – крупнотоннажный продукт органического и нефтехимического синтеза. Ежегодно предприятия химической промышленности производят свыше 15 млн т данного соединения. По производству фенола лидирующие позиции занимают Китай, Тайвань, Южная Корея: объемы производимого азиатскими странами фенола составляют около 45 % от мировых мощностей. Несколько уступают позиции по производству фенола страны Северной Америки (22 % от производимого во всем мире фенола). Центральная Европа во главе с Россией занимает лишь пятое место. В нашей стране выпуском фенола занимаются такие предприятия нефтехимической отрасли, как ПАО «Казаньоргсинтез» (г. Казань, Респ. Татарстан), ПАО «Уфаоргсинтез» (г. Уфа, Респ. Башкортостан) и АО «Новокуйбышевская нефтяная компания» (г. Новокуйбышевск, Самарская обл.) [1].
На сегодняшний день фенол принадлежит к числу наиболее распространенных продуктов нефтехимической промышленности. Он применяется во многих отраслях народного хозяйства, но основной его потребитель – нефтехимическая и химическая промышленность, которые потребляют 70 % вырабатываемого фенола. Фенол используется в производстве пластмасс и синтетических волокон (нейлона и капрона), в нефтеперерабатывающей промышленности, Вследствие своей высокой селективности и эффективности применяется в процессах удаления смолистых веществ и различных полициклических ароматических углеводородов с короткими боковыми цепями, для очистки масел на различных технологических установках [2, 3].
Сфера применения фенола охватывает области производства поверхностно-активных веществ, ядохимикатов и других физиологически активных веществ, стабилизаторов для различных органических материалов. Большое промышленное значение имеет реакция конденсации фенолов с формальдегидом и фурфуролом, приводящая к образованию смол и лаков. Фенолформальдегидные смолы, в свою очередь, являются сырьем для изготовления пресс-порошков с широким диапазоном прочностных показателей, разнообразных слоистых пластиков и клеевых смол. Кроме того, они нашли широкое применение в качестве связующего при производстве древесных плит и фанеры, а также волоконных теплоизоляционных материалов и огнеупоров [4–5].
Фенол применяют и в медицине при производстве вакцин, сывороток и свечей в качестве антиоксиданта и консерванта; в косметологии используется при проведении процедуры глубокого химического пилинга. Известно, что
1,4%-ный раствор фенола обладает антисептическими свойствами: он входит в состав таких препаратов, как «Орасепт» и «Фукорцин», используется при дезинфекции помещений и белья. Проявление фенолом болеутоляющих свойств позволяет применять его при производстве аспирина, а также противотуберкулезных лекарственных препаратов [6].
Впервые фенол был получен выделением из каменноугольной смолы – природного источника фенола и его производных, в 1834 году немецким химиком-аналитиком Ф. Рунге. В течение длительного времени фенол получали именно этим способом, однако вследствие низкого выхода продукта метод потерял свое значение, и на смену ему пришли синтетические способы производства из ароматического сырья [7].
В настоящее время фенол получают по так называемой «кумольной» технологии, открытой советскими химиками Б.Д. Кружаловым, П.Г. Сергеевым и Р.Ю. Удрисом в 40-х годах XX века и базирующейся на гидропероксидном окислении кумола до третичного гидропероксида [5, 8]. Кумол (изопропилбензол), получаемый взаимодействием бензола с пропиленом – продуктом крекинга нефти, окисляют кислородом воздуха до соответствующего гидропероксида, разложение которого в присутствии серной кислоты ведет к образованию целевых продуктов – фенола и ацетона:
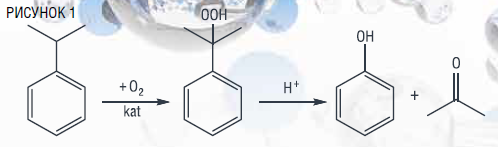
Кумольный процесс является одним из уникальных крупнотоннажных процессов нефтехимии, в результате которого из одного исходного вещества (кумола) образуются одновременно два важных продукта – фенол и ацетон. Однако, несмотря на хорошо отработанную и успешно реализованную во всем мире технологию, данный метод имеет существенный недостаток: образующийся наряду с фенолом ацетон не находит эквивалентного фенолу рынка сбыта.
В настоящее время широкую популярность в нефтехимической промышленности имеют алкильные производные фенола: они применяются в производстве лакокрасочных и полимерных материалов и покрытий, синтетических смол и пластических масс. В последнее время алкилфенолы активно применяются в фармацевтической промышленности при производстве лекарственных препаратов, косметических средств [6].
Так, крезолы (метилфенолы) как индивидуальные изомеры (о-,
м-, п-крезолы), так и их технические смеси используются в производстве синтетических смол, получаемых конденсацией крезолов с альдегидами. Обладая более прочностными характеристиками по сравнению с другими формальдегидными смолами, они хорошо зарекомендовали себя в электротехнике, производстве лаков, пластификаторов и стабилизаторов продукции полимерной промышленности. На основе крезолов синтезируются гербициды и регуляторы роста растений, присадки к моторным топливам. [5, 9].
Диметилфенолы (ксиленолы) также имеют различный изомерный состав и, соответственно, разнообразные сферы своего применения. Так, например, на основе 3,4-ксиленола получают синтетические смолы, пользующиеся большим спросом в электротехнике; а также мономеры для получения термостойких пластмасс. 3,5-ксиленол находит применение в производстве пластификаторов и лакокрасочных материалов; 2,4- и 2,5-изомеры используются в фармацевтической промышленности при получении лекарственных средств [10, 11].
2,4,6-триметилфенол (мезитол), обладая антиокислительными свойствами, является полупродуктом для синтеза витамина Е, антиоксидантом продуктов питания и косметики. Эффективно применение мезитола в качестве регулятора молекулярной массы в процессе получения полифениленоксида окислительной полимеризацией 2,6-ксиленола, представляющего собой термопластичный материал, который может применяться в широком диапазоне рабочих температур и обладает хорошими диэлектрическими характеристиками и устойчивостью к действию кислот, щелочей, перегретого пара [12].
Другим представителем алкилфенолов, с несколько иным, нежели метильным, фрагментом, является пара-трет-бутилфенол – исходное соединение для получения каликсаренов – циклических олигомеров, состоящих из фенольных фрагментов, связанных метиленовыми мостиками, применяемых в аналитической химии в качестве рецепторов для селективного извлечения ионов различных металлов; в биохимии – в качестве соединений-аналогов ферментов, с помощью которых возможно проведение моделирования сложных ферментативных процессов [13].
Среди промышленных способов получения алкилфенолов наибольшее распространение получил синтез этих соединений алкилированием фенола олефинами в присутствии гетерогенных катализаторов, в качестве которых чаще всего выступают цеолиты и ионообменные смолы. Данные процессы характеризуются протеканием большого количества побочных реакций (полиалкилирование, изомеризация и др.), что в значительной степени снижает степень чистоты получаемых соединений, доставляет сложности в разделении продуктов в промышленных масштабах, а также ограничивает сферы их применения [14, 15].
Другим методом получения алкилфенолов в промышленности выступает сульфонатный способ, заключающийся в сульфировании производного бензола серной кислотой с последующим щелочным плавлением полученного бензолсульфоната. К недостаткам данного метода можно отнести применение агрессивных реагентов, жесткие температурные условия, а также образование большого количества отходов сульфита натрия [16].
Устранить указанные недостатки призван разрабатываемый гидропероксидный способ получения фенола и его алкильных производных, базирующийся на доступном нефтехимическом сырье и состоящий из следующих стадий:
· синтез исходных алкилароматических соединений алкилированием производных бензола соответствующими спиртами в присутствии концентрированной серной кислоты в качестве катализатора;
· жидкофазное аэробное окисление полученных алкилбензолов до их третичных гидропероксидов;
· кислотное разложение третичных гидропероксидов алкилароматических углеводородов в целевые продукты – алкилфенолы и соответствующие кетоны.
Первоначально концепция данного метода была апробирована на синтезе крезолов на основе жидкофазного окисления изопропилтолуола:

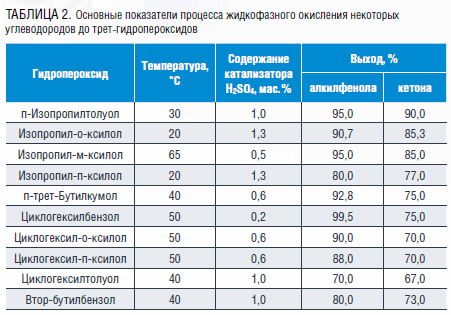
Исходный п-изопропилтолуол (цимол) был синтезирован алкилированием толуола изопропиловым спиртом с последующим переалкилированием полученной эквимолекулярной смеси изомеров изопропилтолуола в присутствии в качестве катализатора хлорида алюминия при температуре 50 ℃ в течение 2 ч. Жидкофазное окисление п-изопропилтолуола было исследовано в присутствии гидропероксида изопропилбензола, выступающего в качестве инициатора радикально-цепных процессов окисления, в интервале температур 110–150 ℃. В данных условиях в течение 2 ч удалось получить гидропероксид изопропилтолуола с содержанием в оксидате, не превышающем 14 мас. %, при селективности его образования 82–84 %, что, вероятно, связано с образованием способствующей распаду гидропероксида куминовой кислоты в количестве около 16–18 мас. % на прореагировавший изопропилтолуол. Интенсифицировать данный процесс удалось с применением N-гидроксифталимида: его применение позволило повысить содержание целевого гидропероксида с 14 до 25 мас. % при температуре 120 ℃ и времени реакции 90 мин. При этом содержание побочной куминовой кислоты значительно снижается до 0,2 мас. %, что благоприятно влияет на технологические показатели процесса. Кислотным разложением гидропероксида цимола, предварительно выделенным из реакционной массы методом экстракции оксидата водным раствором метанола, были получены крезол и ацетон с выходом 95 и 90 % соответственно [9, 17].
Расширить возможности гидропероксидного метода получения монометилфенолов удалось за счет использования данного метода для синтеза диметилфенолов (ксиленолов). Алкилированием ксилолов изопропиловым спиртом в присутствии серной кислоты при мольном соотношении ксилол : изопропиловый спирт : Н2SO4 3 : 1 : 3, температуре 20 °С, и времени реакции 2 ч при полной конверсии спирта получен индивидуальный изопропил-п-ксилол (2-изопропил-1,4-диметилбензол), равновесная смесь изомеров изопропил-о-ксилола, содержащая 4-изопропил-1,2-диметилбензол (50 мас. %) и 3-изопропил-1,2-диметилбензол (50 мас. %), а также смесь изопропил-м-ксилолов, состоящая из
2-изопропил-1,3-диметилбензола (9 мас. %), 4-изопропил-1,3-диметилбензола (26 мас. %) и 5-изопропил-1,2-диметилбензола (65 мас. %). Смеси изомеров изопропил-о-ксилола и изопропил-м-ксилола были подвергнуты реакции переалкилирования в присутствии хлористого алюминия, в результате чего были получены 4-изопропил-1,2-диметилбензол (изопропил-о-ксилол) и 5-изопропил-1,2-диметилбензол (изопропил-м-ксилол) с содержанием основного вещества 100 % и 92 % соответственно. Жидкофазное окисление этих изомеров в присутствии N-гидроксифталимида сопровождается образованием трет-гидропероксида с селективностью 95–98 % при конверсии углеводорода от 8–10 % до
20–25 % в зависимости от структуры исходного углеводорода (таблица 1). Кислотным разложением синтезированных гидропероксидов получены 3,4-, 2,5- и 3,5-ксиленолы совместно с ацетоном с выходом 90–95 % [18].
Триметилфенолы, в частности мезитол, также удалось получить гидропероксидным способом на основе аэробного окисления изопропилмезителена до его гидропероксида с последующим разложением в мезитол и ацетон. Исходный изопропилмезителен с выходом около 75 мас. % был получен реакцией алкилирования мезителена изопропиловым спиртом при соотношении реагентов мезитилен : изопропиловый спирт : серная кислота
3 : 1 : 3, температуре 30 ℃ и продолжительности реакции 4 ч. Окисление изопропилмезителена было изучено в интервале температур 120–150 °С в течение 90 мин в присутствии N-гидроксифталимида, хорошо зарекомендовавшего себя в качестве катализатора окисления ароматических углеводородов. На основании проведенных исследований закономерностей протекания данного процесса были определены его оптимальные условия: катализатор N-гидроксифталимид в количестве 2,0 мас. % от взятого на окисление изопропилмезителена, температура 140 °С, время 90 мин. Рекомендуемые условия позволяют получить оксидат с содержанием гидропероксида изопропилмезителена 8,4 мас. % при селективности образования третичного гидропероксида не ниже 95 %. Кислотным разложением полученного гидропероксида изопропилмезителена синтезированы 2,4,6-триметилфенол и ацетон с выходом 75–85 % [19].
Разработанный гидропероксидный метод весьма эффективно применим и для получения алкилфенолов, содержащих в фенольном фрагменте иные группы, нежели метильные. Так, на основе жидкофазного окисления п-трет-бутилкумола в присутствии
N-гидроксифталимида и его производных с последующим кислотным разложением гидропероксида получены п-трет-бутилфенол и ацетон с выходом алкилфенола выше 90 %. Применение фталимидных катализаторов в данном процессе как индивидуально, так и совместно с гидропероксидным инициатором позволяет достичь конверсии углеводорода 40–55 % при селективности образования гидропероксида более 95 % за 60–75 мин реакции [20].
Стоит отметить, что гидропероксидный метод позволяет варьировать не только спектр получаемых алкилфенолов, но и соответветствующих кетонов. Из представленного выше видно, что наряду с крезолом, ксиленолом и др. данным методом получают ацетон. Однако в последнее время нефтехимическая промышленность столкнулась с проблемой реализации производимого ацетона, поскольку мировой спрос на фенол растет быстрее, чем на ацетон.
В этом отношении нельзя не упомянуть о гидропероксидном способе получения совместно с фенолом циклогексанона – базового мономера полимерной промышленности, являющегося исходным сырьем при получении пластмасс, различных полимеров и изоляционных материалов [22]. Предлагаемый метод, основанный на селективном жидкофазном окислении циклогексилбензола, полученного гидродимеризацией бензола, до трет-гидропероксида и его последующем кислотном разложении в фенол и циклогексанон, позволяет в значительной мере повысить конверсию углеводорода и селективность образования целевого продукта, по сравнению с известными методами получения циклогексанона:
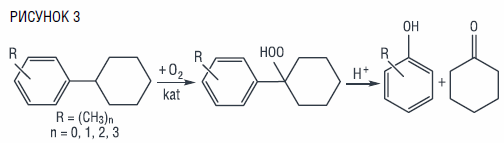
Изучение закономерностей жидкофазного окисления циклогексилбензола было направлено на выбор условий, обеспечивающих высокую скорость окисления до гидропероксида и селективность его образования, что удается достичь при проведении процесса в присутствии N-гидроксифталимида при температуре 110–130 °С: скорость окисления углеводорода повышается примерно в три раза при селективности образования трет-гидропероксида циклогексилбензола 88–92 %. С целью интенсификации процесса сернокислотного разложения гидропероксида было предложено его проведение в присутствии ацетонитрила, позволяющего в 4–5 раз увеличить скорость реакции по сравнению с осуществлением ее в среде других растворителей. При этом удается получать фенол с выходом 87–95, а циклогексанон – 75–78 % мол. при полной конверсии трет-гидроперексида за время реакции 10–20 мин при температуре 50 ℃ [22].
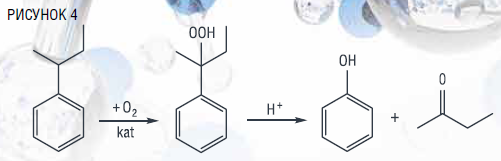
Совместно с циклогексаноном гидропероксидный метод позволяет получать и другие алкильные производные фенола на основе циклогексилтолуола и циклогексилксилолов.
Так, жидкофазным окислением циклогексилтолуола в присутствии
N-гидроксифталимида при температуре 140 ℃ за 90 мин удается накопить до 23 % гидропероксида при селективности его образования около 93 %. Сернокислотным разложением полученного гидропероксида при температуре 40 ℃ представляется возможным получение целевых продуктов – крезола и циклогексанона с выходами
70 и 67 % соответственно [23].
Ксиленолы можно получать и на основе циклогексилксилолов, синтезированных алкилированием о-,м-,п-ксилолов циклогексанолом в присутствии концентрированной серной кислоты при мольном соотношении ксилол : циклогексанол : Н2SO4 3 : 1 : 3 и температуре 10 °С. Вследствие затрудненного выделения индивидуальных изомеров циклогексил-о-ксилола и циклогексил-м-ксилола по причине близости температур их кипения, окислению подвергалась смесь изомеров. Применение N-гидроксифталимида на стадии окисления позволяет повысить скорость окисления изомеров циклогексилксилолов и их конверсию в 1,5–2 раза по сравнению с инициированным окислением, с сохранением высоких показателей селективности образования гидропероксидов. При температуре 120–150 °С, содержании катализатора 1 мас. % и времени реакции 2–3 ч удается накопить
22–23 % гидропероксида циклогексил-о-ксилола, 8–16 % гидропероксида циклогексил-п-ксилола при селективности их образования более 90 %. Кислотным разложением данных гидропероксидов получены 3,4-диметилфенол и 2,5-ксиленол с выходами 86–90 % и циклогексанон – 70–75 % [23].
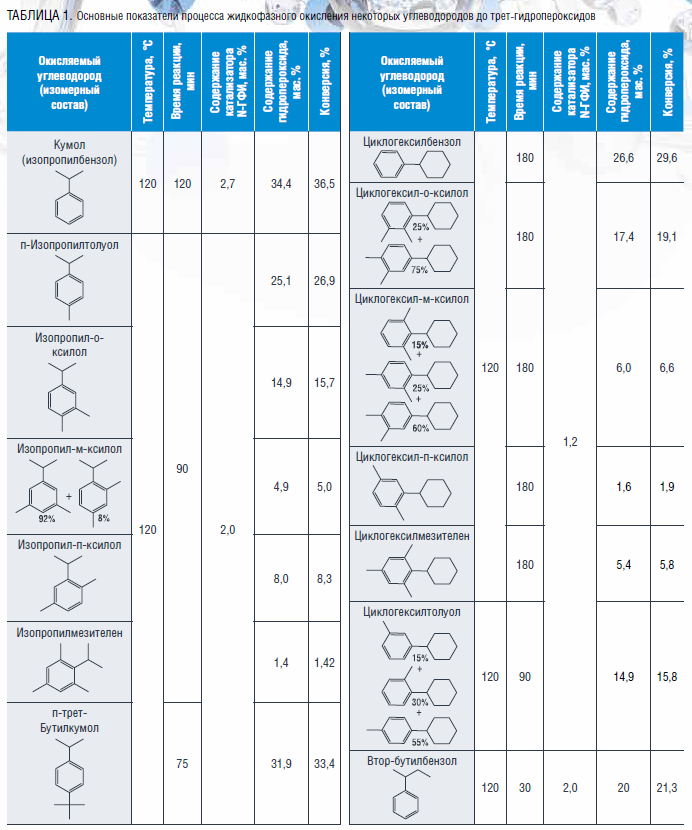
Еще одним применением гидропероксидного способа с целью разнообразия получаемых продуктов является его использование в синтезе совместно с фенолом метилэтилкетона – важного растворителя полимерной, лакокрасочной и кожевенной промышленности.
На основании опыта, накопленного научной группой, на стадии окисления были применены N-гидроксифталимид и его производные, эффективность которых в процессах окисления алкилароматических углеводородов подтверждена на примере ряда изопропильных и циклогексильных производных бензола. Исследованные закономерности окисления втор-бутилбензола до его гидропероксида в присутствии N-гидроксифталимида позволили подобрать оптимальные условия проведения этого процесса, позволяющие получать гидропероксид втор-бутилбензола с его содержанием в продуктах окисления около 35 мас. %. Апробация процесса кислотного разложения гидропероксида втор-бутилбензола позволила сделать вывод о применимости данного метода в синтезе фенола и метилэтилкетона, выход которых составил 80–85 %.
Основные количественные показатели процессов жидкофазного аэробного окисления ароматических углеводородов до их третичных гидропероксидов и кислотного разложения последних в целевые продукты представлены в таблицах 1 и 2.
Таким образом, гидропероксидный метод получения фенола и его алкильных производных совместно с соответствующими кетонами расширяет и дополняет потенциальные возможности «кумольной» технологии получения фенола и ацетона; позволяет адаптировать технологию под получение широкого спектра алкилфенолов и кетонов в зависимости от особенностей рынка химической продукции различных регионов страны. Применение эффективных органических фталимидных катализаторов окисления способствует осуществлению процесса в более мягких условиях, что в значительной степени повышает конверсию исходного сырья, скорость окисления и селективность образования целевых продуктов.
Литература
1. Рынок базовых продуктов нефтехимии: олефины и ароматические углеводороды / Национальный исследовательский университет «Высшая школа экономики», 2019, 70 с.
2. Торлова А.С., Виткалова И.А., Пикалов Е.С. Технологии производства, свойства и области применения композиций на основе фенолформальдегидных смол // Научное обозрение. Технические науки, 2017, № 2, С. 96–114.
3. Яушев Р.Г., Усманов Р.М. Интенсификация процесса селективной очистки масел фенолом // М.: ЦНИИТЭнефтехим, 1988, 76 с.
4. Барг Э.И. Технология синтетических пластических масс // Ленинград: Госхимиздат, 1954, 656 с.
5. Харлампович, Г.Д., Чуркин Ю.В. Фенолы // М.: Химия, 1974, 376 с.
6. Синович А.Д., Павлов Г.П. Фенолы. Химическая энциклопедия: в 5 т. // М.: Большая Российская энциклопедия, 1998, 783 с.
7. Гауптман З., Грефе Ю., Ремане Х. Органическая химия // М.: Химия, 1979,
815 с.
8. Кружалов Б.Д., Голованенко Б.И. Совместное получение фенола и ацетона //
М.: Госхимиздат, 1963, 200 с.
9. Кошель Г.Н., Нестерова Т.Н., Румянцева Ю.Б., Курганова Е.А., Иванова А.А. Цимолы. 4: Получение крезолов и их применение // Вестник МИТХТ, 2012, Т. 7, № 6,
с. 56–59.
10. Киреев В.В. Высокомолекулярные соединения // М.: Высшая школа, 1992,
512 с.
11. Харлампович Г.Д., Калечиц И.В., Чуркин Ю.В. // Химическая промышленность, 1968, № 1, с.16–20.
12. Матвеева О.В., Лакина Н.В., Сульман Э.М., Матвеева В.Г., Долуда В.Ю. Биокаталитическое окисление триметилфенола до полупродукта витамина Е // Вестник Тверского государственного технического университета, 2021, Вып. 12, с. 125–130.
13. Терехов А.В., Занавескин Л.Н., Хаджиев С.Н. Выбор оптимального катализатора процесса получения пара-трет-бутилфенола алкилированием фенола трет-бутанолом // Нефтехимия, 2017, Т. 57, № 4, с. 453–456.
14. Топчиев, А.В. Реакция алкилирования органических соединений олефинами // М.: Изд-во АН СССР, 1962, 254 с.
15. Liu Y. Solvent-determined mechanistic pathways in zeolite-H-BEA-catalysed phenol // Nature Catalysis, 2018, V. 1, P. 141–147.
16. Беркман, Б.Е. Сульфирование и щелочное плавление в промышленности органического синтеза // М.: Госхимиздат, 1960, 268 с.
17. Кошель Г.Н., Курганова Е.А., Румянцева Ю.Б., Фролов А.С., Плахтинский В.В., Нестерова Т.Н., Сапунов В.Н. Цимольный метод получения крезолов и ацетона // Химическая промышленность сегодня, 2014, № 1, с. 11–17.
18. Frolov А.S., Кurganova Е.А., Коshel G.N., Sapunov V.N. Preparation of dimethyl-substituted cumene hydroperoxides // Chimica Oggi. Chemistry Today, 2015, Т 33, № 6,
P. 54–61.
19. Фролов А.С., Курганова Е.А., Кошель Г.Н., Данилова А.С., Кабанова В.С., Мартьянова А.М. Гидропероксидный метод получения 2,4,6-триметилфенола // Известия ВУЗов. Химия и хим. технология, 2022, Т. 65, В. 7, с. 71–78.
20. Курганова Е.А., Фролов А.С., Коршунова А.И., Кошель Г.Н., Яркина Е.М. Гидропероксидный метод синтеза п-трет-бутилфенола // Известия Академии наук. Серия химическая, 2021, № 10, с. 1951–1956.
21. Кошель Г.Н., Курганова Е.А., Фролов А.С., Рыбина Г.В., Лебедева Н.В., Кабанова В.С. Совместный способ получения фенола и циклогексанона на основе бензола // Neftegaz.RU, 2022, № 2, с. 20–24.
23. Курганова Е.А., Кошель Г.Н. Жидкофазное окисление алкилароматических углеводородов и их циклогексильных производных до гидропероксидов в присутствии фталимидных катализаторов // Российский химический журнал, 2014, Т. 58, № 3-4, с. 91–102.






