Фенол и циклогексанон широко используются в различных отраслях промышленности. Несмотря на то, что технология производства этих продуктов нефтехимического синтеза хорошо отработана, процессы имеют ряд недостатков. Российские ученые разработали процесс совместного получения фенола и циклогексанона на основе бензола, устраняющий эти недостатки.
Фенол и циклогексанон – крупнотоннажные продукты нефтехимического синтеза, которые широко используются в различных отраслях народного хозяйства [1, 2]. Циклогексанон (ЦГОН) является базовым мономером в индустрии полиамидных полимеров, пластмасс, изоляционных материалов и др. [3]. Фенол используется для получения дифенилолпропана, фенолформальдегидных смол, алкилфенолов, красителей, лекарственных веществ, а также для получения полимеров и пластмасс [4, 5].
Основное количество фенола и циклогексанона как у нас в стране, так и за рубежом производят кумольным методом и жидкофазным каталитическим окислением циклогексана (ЦГ) соответственно. Несмотря на хорошо отработанную технологию и значительный опыт эксплуатации, эти процессы имеют ряд недостатков. К ним в первую очередь следует отнести тот факт, что образующийся в кумольном процессе ацетон не находит эквивалентного фенолу рынка сбыта, а при окислении циклогексана имеет место крайне низкая (4–5 %) конверсия углеводорода при селективности образования кетона не более 80–85 %. Устранить указанные выше недостатки призван разрабатываемый процесс совместного получения фенола и циклогексанона на основе бензола, который включает следующие стадии:
· гидродимеризацию бензола с образованием циклогексилбензола (ЦГБ);
· селективное жидкофазное окисление циклогексилбензола до трет-гидропероксида (трет-ГПЦГБ);
· кислотное разложение трет-гидропероксида циклогексилбензола в фенол и циклогексанон по схеме:
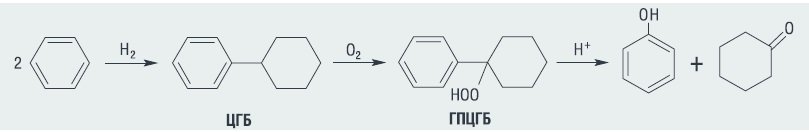
Первой стадией разрабатываемого процесса совместного синтеза фенола и циклогексанона является получение циклогексилбензола. Известные методы синтеза ЦГБ – алкилирование бензола циклогексанолом или циклогексеном, а также дегидрирование бифенила – оказались неприемлемыми для организации крупнотоннажного производства фенола [6, 7]. Альтернативой этим методам получения ЦГБ является процесс гидродимеризации бензола [8–10]. Информация о закономерностях этого процесса в научно-технической литературе практически полностью отсутствовала. В этой связи нами был проведен комплекс исследований этой реакции, который подтверждает эффективность и практическую значимость этого метода получения ЦГБ.
Результаты проведенных исследований позволили рекомендовать для проведения процесса мелкодисперсный катализатор, содержащий 3 % Ni, 20 % WO3 на алюмосиликатном носителе, в качестве которого был использован промышленный катализатор каталитического крекинга марки «цеокар-2», содержащий 12–14 % алюмосиликата в форме «HY» и 2,5 % окислов редкоземельных элементов [11]. Оптимальные температурные режимы приготовления катализатора: сушки (100–120 °С), прокаливания (560–590 °С), восстановления водородом (200 °С) и регенерации были установлены экспериментально с использованием метода ДТА и ДТГ, рентгеноструктурного анализа, метода ртутной порометрии. Разработанный мелкодисперсный Ni-WO3 алюмосиликатный катализатор позволил осуществлять процесс гидродимеризации бензола в статических условиях с конверсией последнего до 50 мол. % при селективности образования ЦГБ 60–65 мол. % [12–13].
Наряду с этим был проработан вариант осуществления процесса гидродимеризации бензола на формованном катализаторе в реакторе барботажного типа. В результате изучения оптимальных условий проведения процесса методом математического планирования эксперимента были получены уравнения регрессии для конверсии бензола и селективности образования ЦГБ, которые могут быть использованы для управления и корректировки параметров процесса. В выбранных условиях: температура 175–195 °С, давление H2 36 атм, скорость подачи водорода 24–44 нл/час, время реакции 2,0–2,5 часа выход ЦГБ на прореагировавший бензол составил 70–75 мол. % при конверсии бензола
30–35 мол. % [14].
В качестве побочных продуктов при этом образуются циклогексан и дициклогексилбензола (ДЦГБ), выход каждого из которых в расчете на превращенный бензол составил около 10–15 мол. %. Было установлено, что смесь бензола с циклогексаном может быть легко выделена из реакционной смеси и подвергнута дегидрированию (катализатор ДВ-3М6, температура 540–560 °С, объемная скорость 0,5–0,65 час-1). В этих условиях выход бензола близок к количественному при полной конверсии циклогексана. Образующиеся при этом бензол и водород могут быть возвращены на стадию гидродимеризации. Нами установлено также, что в аналогичных условиях ЦГБ количественно превращается в дифенил, причем последний можно получать и дегидрированием продуктов гидродимиризации бензола без их предварительного разделения. Эти исследования послужили основой для разработки принципиально нового каталитического метода получения дифенила из бензола. Реакцией деалкилирования с бензолом в присутствии AlCl3 ДЦГБ полностью превращается в ЦГБ [15–16]. Таким образом, процесс получения ЦГБ гидродимеризацией бензола отличается высокой эффективностью и может быть оформлен по технологии, которая существует в производстве циклогексана.
Изучение закономерностей жидкофазного окисления циклогексилбензола было направлено на выбор условий, обеспечивающих высокую скорость окисления ЦГБ до гидропероксида и селективность его образования.
При изучении инициированного окисления циклопентилбензола было выяснено влияние природы и концентрации инициатора, температуры и продолжительности реакции на конверсию углеводородов и селективность образования гидропероксида, изучена кинетика накопления продуктов реакции при различных температурах. В качестве инициатора рекомендовано использовать гидропероксиды этих углеводородов. Исследовано влияние вторичных продуктов окисления ЦГБ (н-амилфенилкетона, 2-ФЦлогексанона, 1-фенилциклогексанола) на скорость и селективность реакции. Показано, что кетоны увеличивают скорость реакции, все перечисленные соединения снижают ее селективность. Дано объяснение влиянию вторичных продуктов на процесс окисления ЦГБ. В оптимальных условиях (температура 125 °С, концентрация инициатора 0,049 моль/л (1,0 вес. %) конверсия ЦГБ 11–12 % достигается за 4 часа при селективности реакции 94–96 мол. % [17–22]. Окисление циклогексилбензола кислородом воздуха под давлением позволило осуществлять данную реакцию в среде растворителей. Проведенными исследованиями показано, что использование в качестве растворителя ацетонитрила (АЦН) в количестве 5,5 моль/л (25 вес. %) обеспечивает увеличение скорости окисления ЦГБ в 1,4–1,5 раза при селективности образования гидропероксида 93–95 мол. % и конверсии углеводорода 12–14 %. Последняя достигается в течение 2,5 часа при температуре 125 ˚С и концентрации инициатора 0,047 моль/л. Увеличение скорости окисления в среде АЦН объяснено образованием более прочного комплекса гидропероксида ЦГБ с этим растворителем (∆Н = 11,7 кДж/моль) по сравнению с ЦГБ. В оптимальных условиях были проведены укрупненные опыты по окислению ЦГБ, которые подтвердили полученные при исследовании результаты.
Интенсифицировать процесс образования ГПЦГБ удалось путем его окисления с использованием различных каталитических систем в присутствии инициатора и без него при температурах 110–130 °С. В результате этого установлено, что резинат марганца в сочетании с соединениями металлов постоянной валентности (стеарат и гидроокись натрия) позволяют увеличить скорость реакции в 1,2–1,4 раза, глубину окисления с 11 до 16 % по сравнению с некатализированным процессом при сохранении высокой селективности окисления.
При окислении ЦГБ в присутствии N-гидроксифталимида (N-ГФИ) при температуре 110–130 °С удается повысить скорость его окисления примерно в три раза при селективности образования трет-ГПЦГБ 88–92 % [23].
Достигнутые при окислении ЦГБ в присутствии N-ГФИ показатели скорости окисления и селективности образования трет-ГПЦГБ соответствуют аналогичным показателям кумольного процесса [24], что, безусловно, повышает целесообразность внедрения процесса совместного получения фенола и циклогексанона в производство.
Исследование реакции кислотного разложения гидропероксида циклогексилбензола, содержащегося в продуктах окисления ЦГБ в присутствии серной кислоты показали, что выход фенола не превышает 50–75 %, а циклоалканов 40–60 % на прореагировавший гидропероксид при продолжительности реакции 80–100 мин. При конверсии гидропероксидов около 90 % в реакционной массе остаются втор-гидропероксиды. Стремление осуществить процесс до их полной конверсии приводит к резкому увеличению продолжительности реакций, что служит причиной получения низких выходов фенола и циклоалканов [25].
Осуществление этой реакции с использованием перекиси водорода, несмотря на лучшие показатели процесса (выходы целевых продуктов возрастают на 10–15 %), связано с применением дорогостоящего реагента и значительной продолжительности реакции (более 2 часов).
С целью интенсификации процесса и выбора условий, при которых весь трет-гидропероксид достаточно быстро и количественно превращался бы в целевые продукты, было исследовано кислотное разложение трет-ГПЦГБ, в результате чего был предложен растворитель – ацетонитрил, позволяющий в 4–5 раз увеличить скорость реакции по сравнению с осуществлением ее в присутствии ЦГБ и других растворителей. При этом трет-ГПЦГБ количественно превращается в фенол, а выход циклогексанона составляет 80–82 мол. % при полной конверсии ГП. Снижение выхода циклогексанона по сравнению с фенолом объяснено протеканием реакции кротоновой конденсации циклогексанона с образованием циклогексенилцсиклогексанона и более высокомолекулярных соединений. Значительное увеличение скорости реакции наблюдается и в двухкомпонентном растворителе ЦГБ – АЦН при весовом соотношении 3:1, что позволило рекомендовать ацетонитрил для разложения продуктов окисления циклогексилбензола [26].
Результаты исследований по кислотному разложению трет-ГПЦГБ подтвердили необходимость и целесообразность осуществления процесса кислотного разложения продуктов окисления ЦГБ в среде АЦН и позволили рекомендовать условия (50 °С, С(H2SO4) = 3–4∙10-3 моль/л, С(ГП) = 0,4–0,8 моль/л, весовое соотношение ЦГБ к АЦН 1:1), в которых выход фенола составил 87–95, а циклогексанона 75–78 мол. % при полной конверсии трет-гидропероксида и времени реакции 10–20 мин. С учетом того, что применение ацетонитрила на стадии окисления ЦГБ до гидропероксида и его кислотного разложения способствует повышению скорости и селективности этих реакций, введение этого растворителя в процесс можно считать обоснованным.
В связи с разработкой технологической схемы процесса и последующей его технико-экономической оценкой были изучены вопросы выделения фенола и циклогексанона из реакционной смеси методом ректификации. Для обоснования данного технического решения были проведены исследования по изучению равновесия жидкость-пар и жидкость-жидкость в системах, образованных компонентами, содержащимися в реакционной смеси [27].
Установлено, что бинарные системы циклогексанон – ЦГБ и фенол – ЦГБ являются азеотропными. Система циклогексанон – фенол образует азеотроп с максимумом температуры кипения, равным 112,4 °С при давлении 60 мм рт. ст. и содержит 74,9 мол. % фенола. Диаграмма фазового равновесия жидкость-пар и ход изотермо-изобар в системе циклогексанон – фенол – ЦГБ указывают на отсутствие в ней тройного азеотропа. При ректификации данной системы в чистом виде могут быть выделены полностью ЦГБ и циклогексанон, избыточный по отношению к его содержанию в азеотропе циклогексанон – фенол, для разделения которого предложен метод азеотропной ректификации с использованием воды в качестве разделяющего агента.
Основные количественные показатели процесса представлены в таблице.

Выполненная на основе результатов проведенных исследований технико-экономическая оценка процесса совместного получения фенола и циклогексанона на основе бензола подтвердила его экономическую эффективность перед раздельными производствами этих веществ.
Установлено, что удельные капиталовложения в расчете на 1 т фенола в 1 т цикологексанона (при мощности производства 120 тыс. т в год) с учетом сопряженных затрат на сырье и энергопроизводства на 24 % ниже, чем на получение эквивалентного количества продукции при раздельных методах производства.
Литература
1. Харлампович Г.Д., Чуркин Ю.В. Фенолы. // М., Химия, 1974, 376 с.
2. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. // М., Химия, 1988, 592 c.
3. Фурман М.С., Гольдман А.М. Производство циклогексанона и адипиновой кислоты окислением циклогексана. // М.: Химия, 1967. 240 с.
4. Торлова А.С., Виткалова И.А., Пикалов Е.C. Технологии производства, свойства и области применения композиций на основе фенолформальдегидных смол // Научное обозрение. Технические науки. 2017. № 2. С. 96–114.
5. Динциес А.И. Основы технологии нефтехимического синтеза. // М.: Гостоптехиздат, 1960. С. 508–509.
6. Залыгин Л.Л., Кошель Г.Н., Фарберов М.И. Синтез фенилциклогексана алкилированием бензола циклогексанолом. Сб. научн. трудов ЯТИ «Химия и химическая технология», 1972, Т. 22, № 2, С. 62–64.
7. Цукерваник И.П., Сидорова Н.Г. Циклоалкилирование ароматических соединений. Журнал органической химии, 1951, Т. 28, № 1, С. 255–260.
8. Кошель Г.Н, Фарберов М.И., Макаров М.М., Глазырина И.И., Бычков Б.Н. Одностадийный метод гидродимеризации бензола в фенилциклогексан и некоторые промышленные синтезы на этой основе. ДАН СССР, 1977, Т. 237, № 1, С. 164–167.
9. Slaugh L.H., Leonard J.A. Hydrodimerisation of benzene to phenylcyclohexane over supported transition metal catalysis. J. Catalysis, 1969, V.13, N 4, P. 385–396.
10. Louvar J.J., Francoy A. Hydroalkylation of aromatic compounds. J. Catalysis, 1970 V. 16, № 1, P. 62–68.
11. Кошель Г.Н, Макаров М.М., Фарберов М.И., Бычков Б.Н., Фрехтман А.А., Розов С.Ю. Синтез фенилциклогексана гидродимеризацией бензола. Межвузовский сб. науч. трудов «Основной органический синтез и нефтехимия». Ярославль, 1975, вып. 3, с. 8–13.
12. Кошель Г.Н, Фарберов М.И., Макаров М.М., Бычков Б.Н. Синтез фенилциклогексана гидродимеризацией бензола. Нефтехимия, 1977, Т. 17, № 5, С. 705–709.
13. Фарберов М.И., Кошель Г.Н, Макаров М.М., Яншевский В.А. Способ получения фенилциклогексана. Авторское свидетельство СССР 443588 Бюл. № 45, 1977.
14. Фарберов М.И., Кошель Г.Н, Антонова Т.Н., Залыгин Л.Л., Соловьева Г.Д. Совместное получения фенола и циклогексанона окислением циклогексана. Нефтехимия. 1969, Т. 9, № 1, С. 107–115.
15. Кошель Г.Н, Фарберов М.И., Черный И.Р., Большаков Д.А., Макаров М.М. Способ получения дифенила и бензола. Авторское свидетельство СССР 416338 Бюл. № 45, 1977.
16. Фарберов М.И., Кошель Г.Н, Залыгин Л.Л., Большаков Д.А., Черный И.Р., Макаров М.М. Способ получения дифенила. Авторское свидетельство СССР 416339 Бюл. № 45, 1977.
17. Фурман М.С., Гольдман А.М. Производство циклогексанона и адипиновой кислоты окислением циклогексана. М.: Химия, 1967. 240 с.
18. Кошель Г.Н, Глазырина И.И., Яблонский О.П., Ласточкина Н.С. Исследование водородной связи гидроперекиси фенилциклогексана методом ЯМР. Известия ВУЗов «Химия и химическая технология», 1975, Т. 18, № 3, С. 427–429.
19. Кошель Г.Н, Глазырина И.И., Фарберов М.И., Изучение некоторых кинетических закономерностей жидкофазного окисления фенилциклогексана. Известия ВУЗов «Химия и химическая технология», 1975, Т. 18, № 3. С. 414–417.
20 Фарберов М.И., Матюков Г.Д., Кошель Г.Н., Яншевский В.А., Бычков Б.Н., Ефимова Н.С., Глазырина И.И. Способ получения фенола и циклогексанона. Авторское свидетельство СССР 442181 Бюл. № 33, 1974.
21. Кошель Г.Н, Глазырина И.И., Фарберов М.И., Бычков Б.Н., Кириченко Г.Н. Способ получения фенола и циклогексанона. Авторское свидетельство СССР 586157 Бюл. №48, 1977;
22. Изучение состава продуктов жидкофазного окисления циклогексилбензола / Кошель Г.Н., Курганова Е.А., Фролов А.С., Коршунова А.И. // От химии к технологии шаг за шагом, 2020, Т. 1, Вып. 1. С. 70–77.
23. Кошель Г.Н., Смирнова Е.В., Курганова Е.А., Лебедева Н.В., Плахтинский В.В., Екимова И.Д., Романова М.В. Интенсификация реакции окисления циклогексилбензола в процессе совместного получения фенола и циклогексанона. Химическая промышленность сегодня, 2010, № 4, С. 40–44.
24. Кружалов Б.Д., Голованенко Б.И. Совместное получение фенола и ацетона. М: Государственное научно-техническое издательство химической литературы, 1963, 200 с.
25. Мантюков Г.Д., Бычков Б.Н., Кошель Г.Н., Фарберов М.И., Ефимова Н.С. Кинетические закономерности кислотного разложения гидроперекиси фенилциклогексана. Известия ВУЗов «Химия и химическая технология», 1975, Т. 18, № 4, С. 542–545.
26. Кошель Г.Н., Глазырина И.И., Бычков Б.Н., Фарберов М.И. Кислотное разложение гидроперекиси фенилциклогексана. Журнал прикладной химии, 1978, том 51, № 10, С. 2325–2329.
27. Караваева А.П., Кошель Г.Н., Осетров В.А. Фазовые равновесия жидкость-пар в тройной системе циклогексанон-фенол-фенилциклогексан. Журнал прикладной химии, 1975, т. 48, № 12, с. 2659–2663.




